La plasticità neuronale corticospinale-motoria promuove il recupero mediato dall’esercizio in umani con danno al midollo spinale
Le strategie riabilitative in umani con lesioni del midollo spinale (LMS) fanno affidamento all’uso dell’esercizio. L’esercizio ha l’obiettivo di guidare i circuiti neurali in una forma attività dipendente per elicitare plasticità e facilitare attività muscolare funzionalmente rilevante al di sotto del livello della lesione. Studi in animali e umani concordano che gli effetti fisiologici e funzionali dell’esercizio possano essere aumentati tramite l’uso della stimolazione neurale, che è pensata aumentare la probabilità di attivare circuiti neurali risparmiati dalla lesione. Anche se questi approcci hanno facilitato il recupero mediato dall’esercizio, l’effetto globale rimane limitato. Chiaramente, esiste un’esigenza per lo sviluppo di interventi che possano più efficientemente ingaggiare connessioni neurali risparmiate per migliorare ulteriormente il recupero funzionale in umani con LMS.
Una strategia che coinvolge i circuiti neurali residui in umani con LMS è la stimolazione corticospinale-neuronale motoria accoppiata (paired corticospinal-motor neuronal stimulation – PCMS). Durante la PCMS, i volley corticospinali evocati tramite stimolazione magnetica transcranica (TMS) a livello della corteccia motoria primaria sono temporizzati per arrivare alle sinapsi corticospinali-neuronali motorie dei muscoli degli arti prima o dopo potenziali antidromici elicitati in neuroni motori dalla stimolazione elettrica di un nervo periferico. PCMS probabilmente elicita cambiamenti della plasticità neurale dipendente dal timing degli spike (STDP) delle sinapsi spinali di motoneuroni somatici. In animali, la plasticità STDP è pensata ingaggiare meccanismi simili alla potenziazione a lungo termine (LTP) che dipendono dall’N-metil-D-aspartato (NMDA). Negli umani la plasticità STDP elicitata da PCMS è bloccata dall’antagonista di NMDA dextrometorfano. I recettori NMDA nel midollo spinale possono influenzare l’output dei motoneuroni e l’attività volontaria facilita la plasticità mediata da PSCM in animali e umani con LMS. In effetti, il numero di individui con LMS che rispondo a PCMS aumenta quando PCMS è applicata durante l’attività volontaria al confronto col riposo. L’esercizio combinato con stimolazione elettrica invasiva o non invasiva del midollo spinale è stato trovato potenziare gli effetti benefici dei protocolli di induzione di plasticità in umani con LMS. Pertanto, gli autori si sono domandati se si potessero aumentare i cambi nella trasmissione corticospinale e nell’output motorio combinando l’esercizio con PCMS. Hanno ipotizzato che PCMS potenzi il recupero correlato all’esercizio attraverso il potenziamento della trasmissione dei circuiti corticospinali a livello midollare.
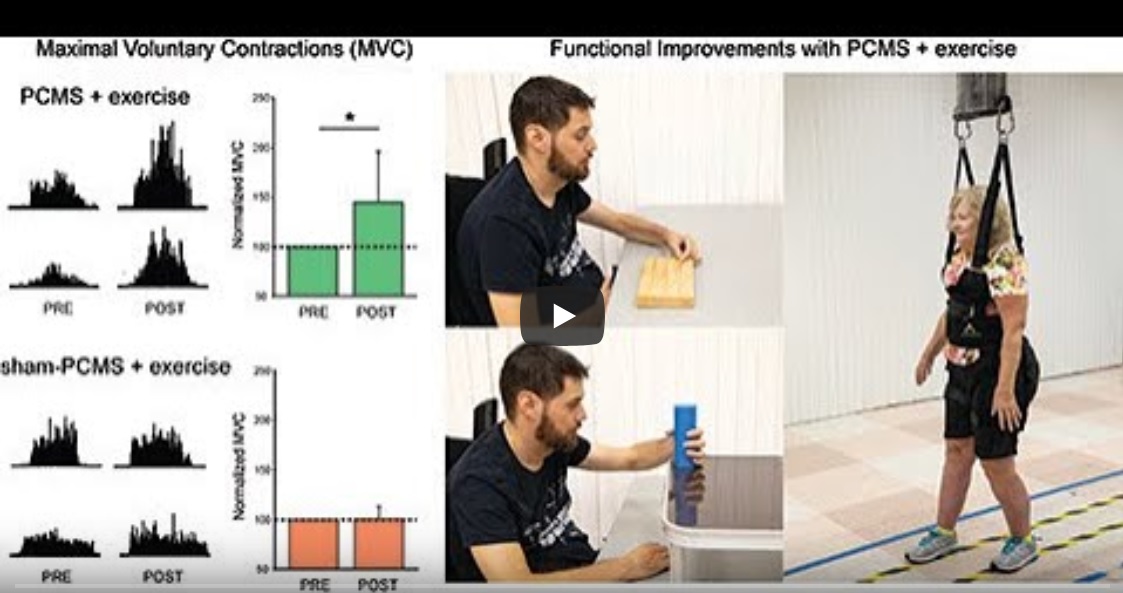
Per testare questa ipotesi, gli autori hanno assegnato in maniera randomizzata individui con LMS cronica incompleta a 10 sessioni di esercizio combinate a PCSM o sham-PCMS. In un esperimento addizionale, hanno testato l’effetto di PCMS senza esercizio in individui con LMS con caratteristiche simili a quelli dell’altro gruppo. Hanno trovato che il drive corticospinale e la contrazione massima volontaria in muscoli bersaglio aumentavano dopo PCMS abbinata o meno a esercizio, ma non dopo sham-PCMS con esercizio. Gli effetti comportamentali si sono preservati per 6 mesi nel gruppo che ha ricevuto PCMS con esercizio, ma non sham-PCMS. Gli autori sostengono che avere come bersaglio le sinapsi midollari sia una strategia efficacie per migliorare il recupero in umani con LCV.
25 individui con LMS cronica incompleta cervicale, toracica o lombare sono stati assegnati in modo randomizzato a ricevere 10 sessioni di esercizio combinato con PCMS o sham-PCMS. Per l’esperimento addizionale sono stati arruolati 13 soggetti con LMS con caratteristiche simili. Durante la PCMS, 180 paia di stimoli sono stati sincronizzati per evocare volleys corticospinali attraverso la TMS a livello della corteccia motoria primaria che giungessero alle sinapsi dei neuroni corticospinali e motori dei muscoli degli arti superiori o inferiori (a seconda del livello della lesione) 1-2 ms prima che i potenziali antidromici fossero elicitati in motoneuroni tramite la stimolazione elettrica di un nervo periferico. I partecipanti si esercitavano per 45 minuti dopo ogni protocollo.
È emerso che il tempo per completare le subcomponenti del Graded and Redefined Assessment of Strength, Sensibility and Prehension (GRASSP) e il test dei 10 metri di cammino è diminuito in media del 20% dopo tutti i protocolli. Tuttavia, l’ampiezza delle risposte corticospinali elicitate dalla TMS e la magnitudine delle contrazioni massime volontarie dei muscoli target è aumentata in media del 40-50% dopo PCMS combinata o meno a esercizio, ma non dopo sham-PCMS combinata con esercizio. Da notare, gli effetti comportamentali e fisiologici si sono preservati a 6 mesi dopo l’intervento nel gruppo che ha ricevuto PCMS con esercizio, ma non nel gruppo che ha ricevuto esercizio combinato a sham-PCMS, suggerendo che la stimolazione contribuisce a preservare i guadagni.
Questi risultati suggeriscono che PCMS sia una strategia efficacie per facilitare il recupero mediato dall’esercizio in umani con LMS. Gli autori hanno adattato la PCMS per avere come bersaglio muscoli con un drive volontario residuo al di sotto del livello di lesione in individui con lesione cervicale, toracica e lombare, evidenziando il potenziale clinico di questo approccio. Propongono che PCMS rappresenti una strategia per migliorare le connessioni corticospinali e preservare il recupero mediato dall’esercizio in umani con differenti gradi di paralisi e livelli di LMS.
L’esercizio è una delle più comuni strategie usate nella riabilitazione per LMS. in questo lavoro è emerso che 10 sessioni di esercizio degli arti superiori e inferiori migliorino la funzione manuale fine e grossolana e l’abilità di camminare in individui con LMS cronica incompleta. Importante, è emerso che 10 sessioni di esercizio non sono state sufficienti per elicitare cambiamenti dell’ampiezza dei potenziali motori evocati (MEP) e della massima contrazione volontaria (MCV) in nessuno dei muscoli testati. Ci si potrebbe aspettare che gli outcome elettrofisiologici siano più sensibili nell’individuare cambiamenti dopo un intervento rispetto all’esaminazione funzionale clinica, che usa scale nominali. Infatti, la letteratura concorda che gli outcome elettrofisiologici siano necessari per aumentare la sensibilità dell’esaminazione clinica a seguito di LMS. Pertanto, qual è l’origine dei cambiamenti delle performance motorie che gli autori hanno osservato con l’esaminazione clinica? L’evidenza mostra che individui con danno del sistema nervoso centrale, inclusi quelli con LMS, migliorino i movimenti attraverso compensazione o l’uso di movimenti alternativi per raggiungere lo stesso scopo, cosa che potrebbe avere contribuito a questi risultati. La complessità dei movimenti multi-articolari durante i compiti di movimento della mano testati in questo lavoro tramite l’esaminazione clinica rende difficile escludere la possibilità che la compensazione abbia contribuito ai risultati. Gli autori favoriscono la possibilità che MEP e MVC non siano cambiati quando l’esercizio era combinato con sham-PCMS in quanto l’esercizio non ingaggi in modo effettivo il circuito corticospinale. Questo è supportato dal loro risultato che mostra che quando la PCMS era combinata con l’esercizio sia MEP che MCV siano aumentati dopo 10 sessioni.
Gli autori concludono che PCMS fortifichi le connessioni tra i neuroni corticospinali e i motoneuroni e aumenti l’output motorio aumentando la plasticità sinaptica. Questi risultati indicano che la stimolazione non invasiva con bersaglio le sinapsi spinali rappresenti una strategia efficacie per facilitare il recupero mediato dell’esercizio in umani con differenti gradi di paralisi e livelli di danno del midollo spinale.
Corticospinal-motor neuronal plasticity promotes exercise-mediated recovery in humans with spinal cord injury
Hang Jin Jo and Monica A. Perez
https://academic.oup.com/brain/article-abstract/143/5/1368/5827586?redirectedFrom=fulltext